実験的位相決定法について
蛋白質の構造解析は、医薬品開発やバイオテクノロジー分野において非常に重要です。
蛋白質の立体構造を解明することで、薬剤のターゲット部位や作用メカニズムを明確にし、新薬の開発に貢献することができます。
X線回折法を用いることで蛋白質の結晶から回折パターンを取得することができますが、この回折パターンからは「位相情報」を得ることができません。この「位相問題」が蛋白質構造決定の大きな課題となります。
実験的位相決定法は、この位相問題を解決するために用いられる手法です。
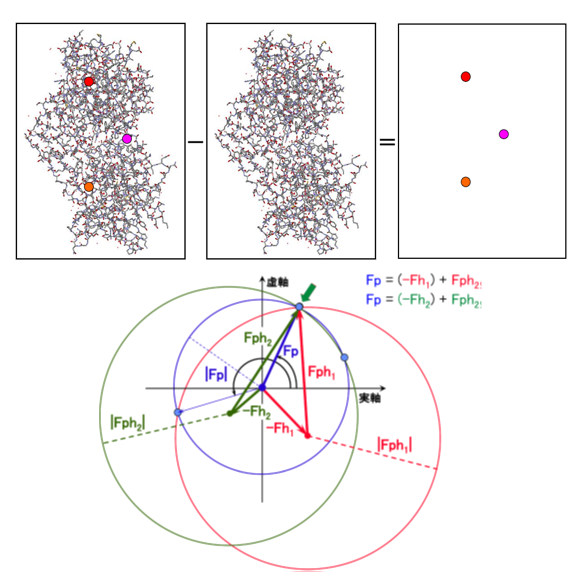
主に異常分散法や重原子同型置換法が利用されます。
現在、実験的位相決定法では異常分散法が主流であり、特にシステインやメチオニンに含まれる硫黄原子の異常分散を利用する手法が広く用いられています。
異常分散法では、硫黄を含むアミノ酸であるシステインやメチオニンの位置を利用し、X線がこれらの元素に照射されるときの散乱パターンの変化を利用します。
これにより得られる位相情報を基に、蛋白質の三次元構造を推定します。
硫黄原子は、X線に対して強い散乱を示すため、これを利用することでより高精度な構造解析が可能となります。
一方、重原子同型置換法は、蛋白質中に重金属などの重い元素を導入し、その元素の位置を基に位相を推定する方法です。
重金属がX線に対して強い散乱を示す特性を利用し、回折パターンから位相情報を解読します。
この方法も依然として有効ではありますが、異常分散法が主流となっている現在では、特定の条件下で使用されることが多いです。
これらの手法は、構造が未知である蛋白質に対しても適用可能で、分子置換法のように既知の構造を基にした解析を行う必要がありません。
分子置換法は、ターゲット蛋白質と既知の構造との相同性が高い場合に適用できる手法ですが、相同性が低い場合には適用が難しいという制限があります。
それに対し、実験的位相決定法は、相同性が低くても適用可能であるため、より広範な蛋白質の構造解析に利用されています。
実験的位相決定法は、蛋白質の構造解析における重要な技術として、医薬品開発やバイオテクノロジー分野で活用され、さらなる研究の発展に寄与しています。
リガクおすすめの製品

